GMP/Data Integrity/Validation of Pharmaceutical Manufacturing医薬品製造におけるGMP/データインテグリティ/バリデーションについて
データインテグリティとは
-
データインテグリティとは、情報処理などの分野で使われる用語で「データの完全性」とも訳され、「完全で⼀貫性があり正確であるデータ」のことを意味しています。製薬業界では、主に患者の安全性確保を目的にデータインテグリティが使われています。
データインテグリティ自体は決して新しい概念ではありません。これまでGMP(Good Manufacturing Practice)などにおいて要求されてきた、いわば常識と言える考え方です。 
-
GMPとは
GMPとは「Good Manufacturing Practice」の略称で、「製造管理および品質管理の基準」のことです。GMPでは、原料の仕入れから出荷までの製造管理や品質管理の基準が定められています。なかでも、医薬品に関する基準は「医薬品GMP」と呼ばれています。

製薬業界におけるデータインテグリティでは、FDAやEMAが提示する『ALCOA原則』および『CCEA』に則ったデータであることが求められています。
-
ALCOA原則について
そもそもデータインテグリティとは、データがライフサイクルを通じて整合性・一貫性を保っており、欠損がないことを意味します。「ALCOA」は、データインテグリティ(データの完全性)を証明するために満たすべき要件のことです。
「ALCOA」の表記は、それぞれ「Attributable(帰属性)」「Legible(判読性)」「Contemporaneous(同時性)」「Original(原本性)」「Accurate(正確性)」の頭文字を取ったもので、守るべき要件の内容を示しています。 
データインテグリティが求められている背景
-
何よりも医薬品の利用者である患者の安全を守ることが、医薬品業界において、データインテグリティへの対応が求められる最大の理由です。
万が一、医薬品の記録に不整合、欠損、さらには改ざんなどがあった場合には、患者の健康や生命まで脅かされることになります。そのため、研究開発から製造、販売に至るプロセス全体で企業はデータインテグリティの確保に努めなければなりません。 
- 01
不正製造の発生が大きな社会問題に
近年、データ偽装や改ざんなど、データの不適切な取り扱いに起因する不正が大きな社会問題となっています。その結果、医薬品製造においては以前より必須とされていたデータインテグリティの重要性が、より広く認識されるようになってきました。
特に2015年以降は、世界各国の規制当局が相次いでデータインテグリティにフォーカスしたガイダンスを発表、査察で不適合が指摘されるケースや不正が原因で事業者が製造許可の取り消しなどの重い処分を課せられるケースも報告されています。
- 02
各国のガイドライン及び日本国内の改正GMP省令の発令
前述の通り、データインテグリティに関する問題の増加に対して、世界各国の規制当局がデータインテグリティについてのガイダンスを次々に発表しています。
2015年にMHRA、2016年にPIC/S・WHO、2018年にはFDAがガイドラインを発行、データインテグリティへの対応の必要性を求めています。
日本国内においては、2014年にPIC/Sへ加盟したことで、国際基準に即したデータインテグリティ対応が求められるようになりました。さらに、2021年8月からは改正GMP省令が施行され、データインテグリティに関する要件が追加され、対策が必須となりました。
- 03
パラダイムシフトをもたらしたIoT化の進展
工場の自動化に大きな進展をもたらした「インダストリー4.0」の概念を、製薬業界仕様にしたものが「ファーマ4.0」です。この考え方をもとに、医薬品製造業界でもIoTを活用したスマート工場化が進んでいます。それに伴い、GMP記録の管理媒体も「紙」から「コンピュータシステム」への移行が前提となりました。電子データによる記録が普及することで、コンピュータ化システムバリデーション(CSV)や監査証跡などの対応が新たに必要となり、データインテグリティ対応のあり方そのものを見直さなければなりません。世の中のパラダイムシフトがデータインテグリティの重要性を再認識させました。
データインテグリティが進まない理由
-
MESとPLCの間に紙の書類が残る、
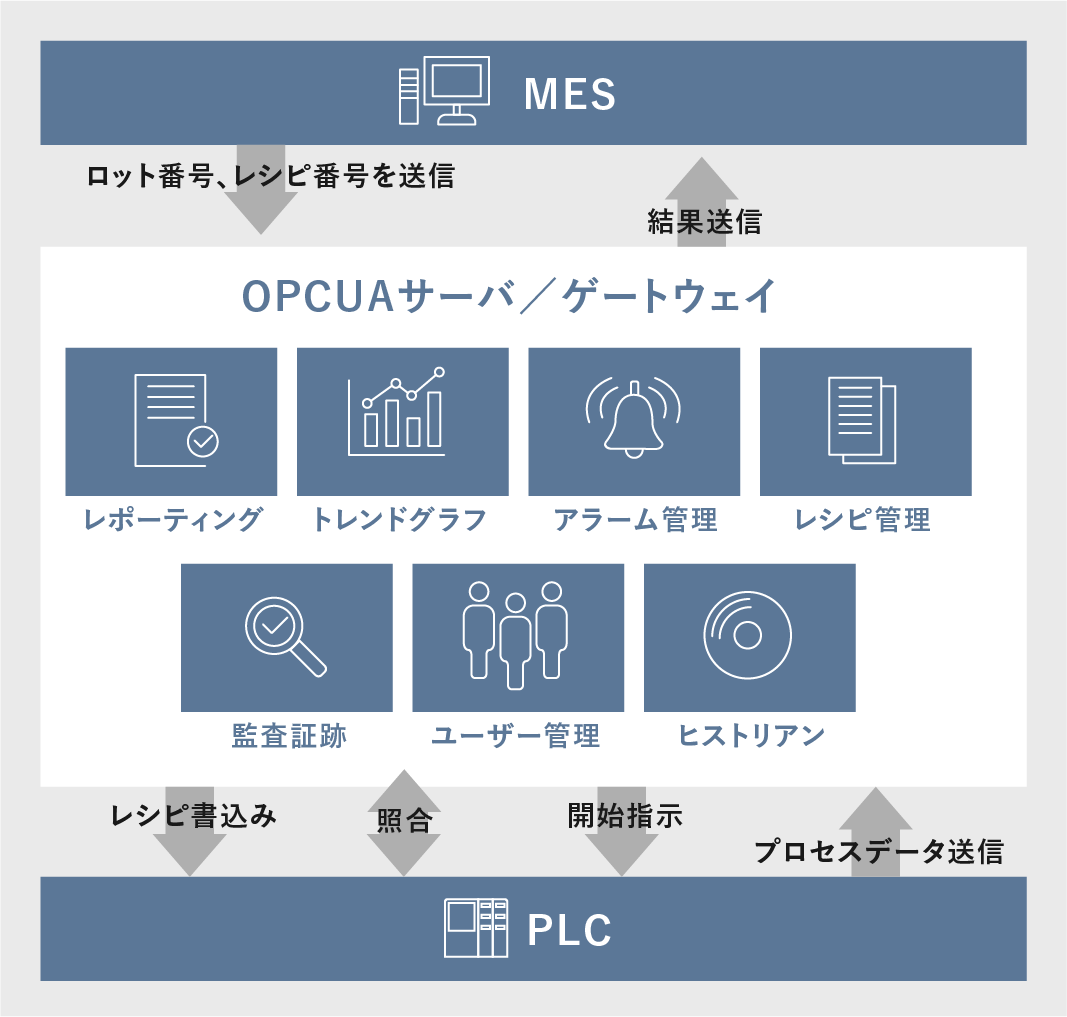
日本ならではの特殊事情の存在データインテグリティに対応するため、⽣産現場のデジタル化を推進する場合、制御装置であるPLCなど下位システムの持つ情報を、上位システムのMES(製造実行システム)へ集積し、上位システムから下位システムへ適切な指⽰を⾏えることが必須となります。
MESとPLCの間にソフトウェアプラットフォームが導⼊されていない製造現場では、紙による指示書と作業記録をベースに、人が介在しているケースがまだまだ多く残っています。
このMES – PLC間をデジタル化によるシステム統合を計ることで、記録、操作、承認作業の自動化・電子化が実現できます。 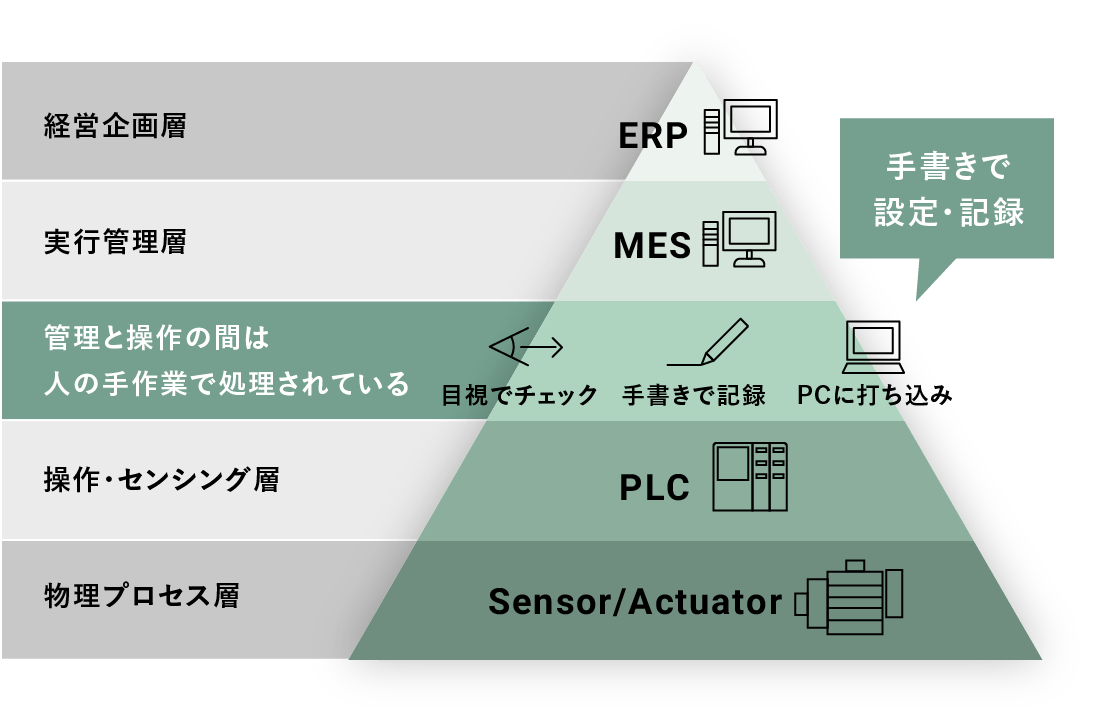
-
デジタルによるデータの一元管理を拒む壁
ひと言でデジタル化と言っても、実際のところ古い機材と新しい機材が混在している製造現場では、既存のシステムの置き換えも難易度が高く、正直どこから手を付けてよいかわからないというのが実情ではないでしょうか。
実際のところ、データインテグリティ対応のために、すべての機器を入れ替えるのは時間やコストはもちろん、専門的なノウハウも必要となってきます。さらに、医薬品業界特有の「コンピュータ化システムバリデーション(CSV)」のハードルも高くなることは間違いありません。最適なソフトウェアの選択と伴走できるシステムインテグレータの支援が求められる所以です。 
-
コンピュータ化システムバリデーション(CSV)とは
医薬品製造におけるコンピュータ化システムバリデーション(CSV:Computerized System Validation)は、医薬品、医薬部外品、化粧品および医療機器の開発・製造に使用されるコンピュータ化システムについて、開発プロセスの最適性と妥当性を検証し文書化することを求める規定です。
厚生労働省はCSVの実施にあたり、「医薬品・医薬部外品製造販売業者等におけるコンピュータ化システム適正管理ガイドライン」を定めています。このガイドラインは、欧米のGAMP5やPIC/S等のCSVガイドラインと整合性があり、コンピュータ化システムの開発から検証、運用、廃棄までのライフサイクルの考え方を採用したものです。「医薬品及び医薬部外品の製造管理及び品質管理の基準に関する省令(GMP省令)」や、「医薬品、医薬部外品、化粧品及び再生医療等製品の品質管理の基準に関する省令(GQP省令)」に関わる業務を遂行するシステムについては、ガイドラインを遵守する必要があります。 
データインテグリティ対応、デジタル化を促進するために、最適なソフトウェアパッケージを活用
-
前述の通り、データインテグリティ対応、⽣産現場のデジタル化に向けては、医薬品業界を熟知したソフトウェアパッケージの活⽤が有効な選択肢のひとつです。最も分かりやすいのは、既存のタッチパネルをSCADAに置き換える方法。完全な置き換えが難しい場合には、重要なGMP関連パラメータ関連の設定、監視、記録だけをSCADAから行うよう、部分的に改造する手もあります。
これにより、GMP関連パラメータに絞った形で、データインテグリティが確保された運用が可能になるうえ、コンピュータ化システムの変更範囲を一部に限定することで、バリデーションにかかる労力も大幅に削減されることになります。
また、データインテグリティに対応することで、製品の品質向上はもちろんのこと、安全が担保され、結果として企業の社会的な信用が高まる好循環につながります。
当社では、データインテグリティの対応を支援できるシステム・ツールとして、シーメンスのMESパッケージ「Opcenter Execution Pharma」「SIMATIC SCADA SYSTEM」を取り扱っています。
当社では生産設備やシステムのリプレイスから工場全体のスマート化まで、データインテグリティ対応に向けての幅広い支援が可能です。データインテグリティについて課題をお感じの際には、ぜひ当社までお気軽にお問い合わせ頂ければ幸いです。